泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-04-23 转至微博:
|
医药网4月16日讯 4月3日国务院办公厅发布《关于改革完善仿制药供应保障及使用政策的意见》。
的确,完善及鼓励仿制药有利于国内仿制药行业的发展,但是其利好在于对原研药的替代,而不是做原研药的替身。仿制药政策对整个行业的长远发展绝对是好事,但同时也是行业洗牌的过程,大批药企将会消失。
鼓励仿制药,不再做原研药的替身
《关于改革完善仿制药供应保障及使用政策的意见》(下简称《意见》)一文分为“促进仿制药研发、提升仿制药质量疗效、完善支持政策”三部分,其言下之意是要鼓励仿制药研发,通过一致性评价的仿制药,国家会给予配套政策支持和鼓励。
正如4日《国务院发文,仿制药迎重大利好(附文件及解读)》一文引用专家9字点评的“快点有(增量)、还得好(质量)、用得上(可及)”那样,“快点有”是基本愿望,“还得好”是基本要求,用的上是最终目的。
《意见》基调是鼓励仿制药的研发和使用,最终达到对原研药的替代,降低医保支出的目的。
但总体而言,我国的仿制药水平尚处于初级阶段,我国仿制药的治疗和疗效与原研药还存在较大的差距,因此目前阶段我国仿制药大多情况下只是在患者用不起原研药或者没有原研药的替身,而不是对原研的替代。因此,价格就难以和原研药在一个层次。
因此,仿制药“打铁还需自身硬”,需要坚定地推进仿制药质量和疗效一致性评价,从而形成对原研药的替代。
鼓励仿制药,一致性评价是一项长期政策
我国“快点有(增量)”并不存在问题,我国目前已成为世界上第二大用药大国,并且增速远远高于全区行业整体水平。国内规模以上药企有5000多家,其中化学原料药和制剂各有1100家左右,药品批文近17万条,国产药批文超过16.5万余条,国产药中有10余万条是化学药,其中有90%是仿制药。
因此,现在重点就落在“还得好”上了,也就是说质量和疗效管理会贯穿全程。如何达到与原研药质量和疗效一致才是关键。可见,仿制药一致性评价是未来几年甚至几十年需要推进的工作。
仿制药一致性评价难度大
仿制药药品质量一致性评价还在摸索前进。从我国自2016年重启仿制药一致性评价工作以来至今,虽然备案数达到几千条,但是进入审评阶段的仅有50多个品种。并且,按照监管部门的要求在2018年年底完成一致性评价的289个口服基药品种目前仅有5个品规有企业完成。
近日,监管部门也放松了时限要求。原因在于一方面需要企业有资金实力;另一方面需要国家相关的临床试验机构配套不足。 从美日推行仿制药一致性评价的历史和经验也可以看到,也是一些长期的过程。
据相关资料显示,日本经历22年,美国则为23年,最终在两国均不定期更新发布仿制药橙皮书。可见,仿制药一致性评价工作是一项未来多年长期推行的政策。
鼓励仿制药,仿制药行业大洗牌时代来临
※大批仿制药批文和品种消失
以日本通过一致性评价前后药品批文许可情况来看,在20世纪70年代和我国现在数量情况基本相似,有10万余条药品批文许可,到2013年药品批文许可剩下不到1.9万个,流通的为1.5万个左右。
 注:来源于兴业证券研究所,供参考。
根据我国目前相关的仿制药一致性评价相关政策文件和目前进展情况来看,大批批文将会消失也是大概率事件。根据相关政策文件规定,一旦一个药品又一家企业通过一致性评价后,其他企业需要在3年内完成,如果逾期未完成的则不再予以注册。通过我国现有的进展情况来看,也是如此。
虽然仿制药一致性评价的备案是热火朝天,不定期会发布更新。截至目前,备案条数超过500条,涉及品种数量达880余个,备案企业数量超过850家。但实际进入审评阶段的仅有55个产品的100余个受理号。
以当初要求药企在2018年年底完成一致性评价的289个品种来看,目前进入审评阶段的不到1/10,仅有26个。
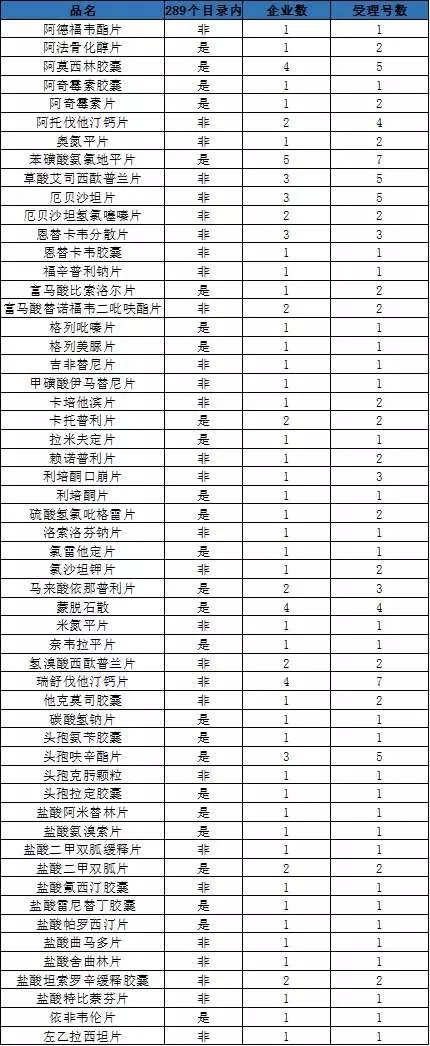 注:根据CED/CFDA等文件综合分析,供参考。
截至目前,我国发布了两批通过一致性评价的公告,共有14个品种22个品规。其中属于289个目录内仅有屈指可数的5个。尽管在近期的相关公开文件显示要求在2018年底完成一致性评价的品种将会在时间上有所延长,但笔者预计将还是会有较多的品种放弃一致性评价。
 注:根据CED/CFDA等文件综合分析,供参考。
批文大量消失的还有一个因素我国有大量批文过度重复的品种。根据2018年年初CFDA发布的我国过度重复的药品提示信息显示,我国同一个品种批文数超过20个的品种有近300个。
其中,批文数、企业数、近三年在销批文数和在销批文企业数均在100个以上的品种就有17个。有甲硝唑、葡萄糖和维生素C品种的批文数量竟在1000条以上,重复程度之高令人咋舌。
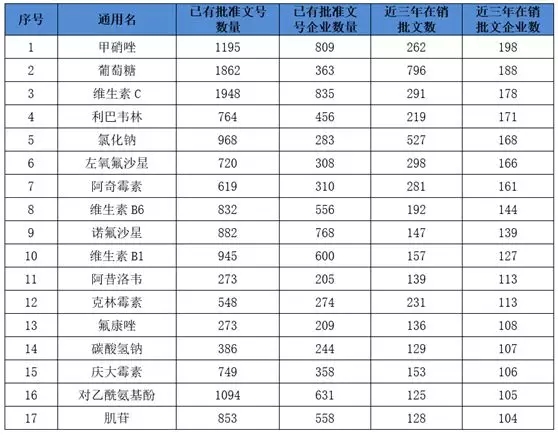 注:根据CFDA公开资料整理,供参考。
根据国家仿制药一致性评价相关政策规定,一旦一个品种有3个企业通过一致性评价后将不再受理其他企业,可见批文将会大批消失。
※大批仿制药企业会消失
伴随着批文大批消失的也会有大批仿制药企业消失。此处还是以日本实施仿制药一致性评价前后企业消失的数量情况来看,近8成的企业将可能会消失。
在日本实施仿制药一致性评价前后,药企数量由20世纪70年底的1300多家下降到20世纪90年代的不到900家,在2011年仅仅剩下约300家,其中主要生产处方药的厂家约为 100 家,而主要生产仿制药的企业仅为 20 多家。
 注:来源于兴业证券研究所,供参考。
由此可以想象,在未来多年将是我国仿制药大洗牌的时代。目前我国规模以上化学药企业(含原料药和制剂)在2200家左右,生物制品企业大约在900家左右,合计在3000家左右。
预计在仿制药一致性评价完成后,乐观估计我国化学药企业和生物企业总数将会剩下1000家左右,甚至是500-600家。
可见,鼓励仿制药的政策措施是“有人欢喜有人愁”,而不是药圈所传的那么乐观,皆是繁花。对那些没有经济实力和品种筛选能力的药企来说,将是末日。
因此仿制药企业要清醒地认识到这一点,做好应对措施,避免成为消失队伍里的一员。因为,机会总是给有准备者,鲜花和掌声也只属于成功者。
关键词:
|