泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2020-06-15 转至微博:
|
医药网6月12日讯 6月9日,石药欧意药业注射用硼替佐米、上海司太立制药碘海醇注射液的上市申请在审状态变更为“在审批”,两个品种均以仿制4类申报,一旦获批生产将视同通过一致性评价。米内网数据显示,2019年中国公立医疗机构终端注射用硼替佐米、碘海醇注射液销售额分别为14.42亿元、38.37亿元。
表:近期部分变更在审状态的品种
 硼替佐米属于双肽基硼酸盐类似物,是全球第一种人工合成的用于临床的新型蛋白酶体竞争性抑制剂,用于治疗多发性骨髓瘤和套细胞淋巴瘤。该产品由Millennium Pharmaceuticals,Inc(后被武田收购)研发,2003年5月13日获得FDA批准上市,2005年进入中国市场。目前武田负责美国市场的销售,2019年销售额1183亿日元,而强生负责美国之外的市场销售,2019年销售额7.51亿美元。
图1:2015-2019年中国公立医疗机构终端注射用硼替佐米销售情况(单位:万元)
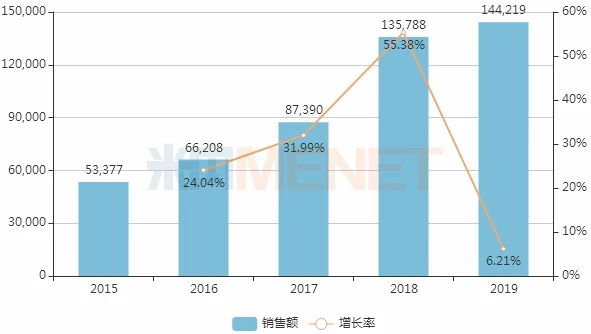 米内网数据显示,近几年来,注射用硼替佐米在中国城市公立、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端销售额逐年上涨,2019年达14.42亿元,同比增长6.21%。
图2:2019年中国公立医疗机构终端注射用硼替佐米厂家竞争格局
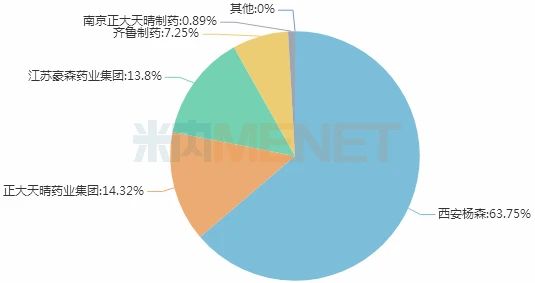 目前国内市场有6家仿制药及1家原研药企拥有注射用硼替佐米生产批文,在2019年中国公立医疗机构终端竞争格局中,西安杨森以63.75%的市场份额排位第一,正大天晴、豪森所占市场份额均超过10%。
米内网数据显示,注射用硼替佐米还未有企业过评,齐鲁、豪森、正大天晴等5家药企已提交一致性评价补充申请,目前均处于“在审评审批中(在药审中心)”;扬子江、石药欧意药业、国药等7家药企以新注册分类提交注射用硼替佐米上市申请,石药欧意药业进展最快,目前已进入“在审批”状态,有望首家过评。
碘海醇注射液为X射线造影剂产品,5月12日,恒瑞发布公告,与司太立就碘海醇注射液及碘帕醇注射液签署合作协议,恒瑞将负责合作产品在中国大陆的商业化运作,包括营销、自行或与经销商合作销售。碘帕醇注射液已于今年5月份获批上市,碘海醇注射液也上市在即。
图3:2015-2019年中国公立医疗机构终端碘海醇注射液销售情况(单位:万元)
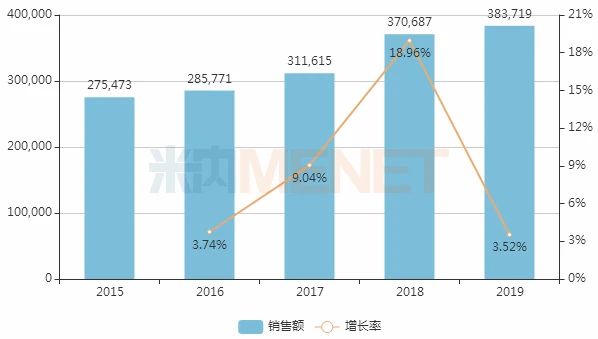 米内网数据显示,碘海醇注射液在2017年中国公立医疗机构终端销售额首次突破30亿元之后,仍以良好的增速保持增长,2019年达38.37亿元,同比增长3.52%。
图4:2015-2019年中国公立医疗机构终端碘海醇注射液TOP3厂家
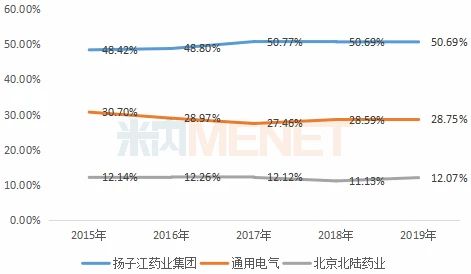 目前碘海醇注射液的市场由扬子江主导,紧接着是通用电气及北陆药业。扬子江于2019年7月提交该产品一致性评价补充申请,目前处于“在审评审批中(在药审中心)”,上海司太立独家以新分类报产,目前已进入“在审批”,有望首家过评。
来源:米内网数据库
注:数据统计截至6月11日,如有疏漏,欢迎指正!
关键词:
|