泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-08-01 转至微博:
|
医药网7月26日讯 境外仿制药的春天已然到来。
2018年7月10日,国家药品监督管理局发布《接受药品境外临床试验数据的技术指导原则》的通告(2018年第52号)。该指导原则所涉及的境外临床试验数据,包括申请人通过创新药的境内外同步研发在境外获得的临床试验数据,以及具备完整可评价的生物等效性数据。这将会推动越来越多的境外仿制药(即5.2类药品,境外上市的非原研药品申请境内上市)申报上市。
境外数据可接受性
境外数据放开利好,须先过“种族”大关
利好中外同步试验、东亚人群试验
如表1所示,国家药品监督管理局认可的境外临床试验数据,主要从三方面进行考虑:一是境外临床试验数据的真实性、完整性、准确性和可溯源性,二是境外临床试验数据的有效性和安全性,三是境外临床试验数据是否存在种族差异。
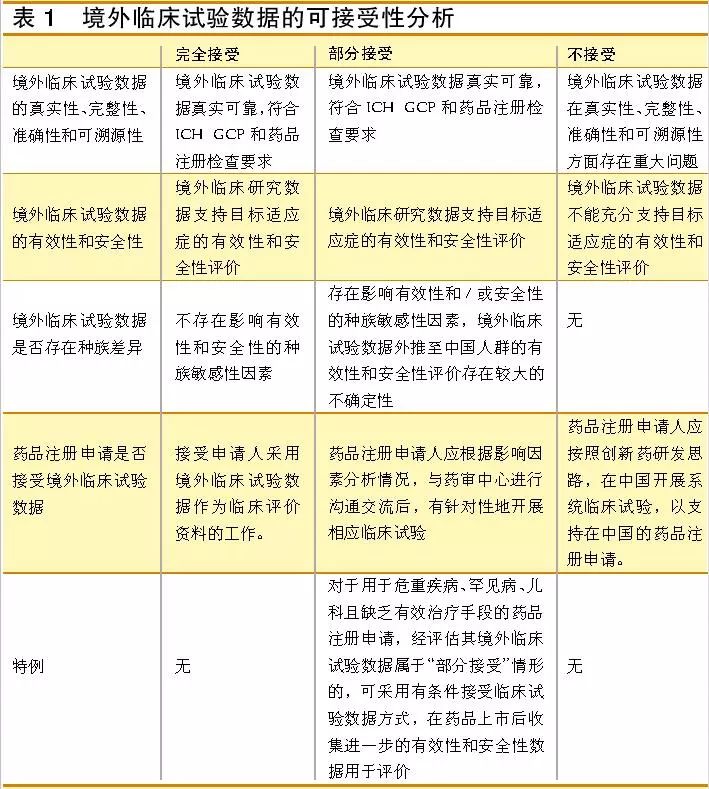 其中,种族差异分析需要对临床药理学数据的区域和人种等多角度进行种族敏感性分析,以确定境外临床试验数据是否适用于中国人群;以及遵循ICH关于接受国外临床资料的种族影响因素(E5)要求,确证有效性和安全性方面中国亚组与世界总体人群的一致性。
综上所述,1类进口新药(境内外均未上市的创新进口药)若是有做中外同步的多中心临床试验,5.1类药品(境外上市的原研药品申请境内上市)和5.2类进口仿制药对应的原研药有做东亚人群特别是中国亚组的临床试验的产品,将有望在《接受药品境外临床试验数据的技术指导原则》政策中受益。
对“种族”不敏感的药物特性
另外,药物的某些特性(化学分类、代谢途径或药理学分类)本身就决定了其是否易受种族因素影响。
一些药物性质将极大可能提示对种族因素不敏感。对种族因素不敏感的药物性质包括:具线性药代动力学(PK);在推荐剂量和给药方案范围内,呈平直的药效动力学曲线(PD)(显示药物有较好的耐受性);广泛的剂量范围显示药物有较好的耐受性(很少的剂量变化不会引起药物作用的巨大改变);代谢少或以多种途径代谢(不会因为仅有单一途径代谢而增加药物相互作用的可能性);高生物利用度(不受饮食吸收作用的影响);蛋白结合率低;药物-药物、药物-饮食、药物-疾病的相互作用小;非全身作用方式;被不恰当使用的几率小(容易被不恰当使用的药品如镇痛及镇定药)等。
相对应地,如前体给药,特别是具有潜在种族差异的酶的转化药,则对种族因素敏感。
借鉴ICH,我国短期将从严监管境外数据
此外,根据ICH的E5,中国接受国外的临床试验数据,还可能要考虑以下部分的内容:
1)特殊亚人群的临床试验数据,如肝功能不全及肾功能不全的病人等;
2)人种或根据当地的治疗方式调适剂量和给药方法;
3)药物相互作用研究。
根据ICH的经验,随着对国外地区临床数据的地区间认可经验的增加,药监部门对哪些情况下需要补充研究的安全有效性、剂量和给药方案的药效学临床资料会有更好的理解,地区间对补充研究的需求也会逐渐减少。
鉴于此,我国药监局短期内可能会从严监管境外试验数据,进口药的上市地为美、日、英、德等要求较高的国家相对更容易被认可。
注册申报情况
1类、5.1类、5.2类申报数据PK
5.2类申报积极性渐升
咸达药海遨游数据显示,化学药品注册法规改革后,2017年以前进口注册申报还是以5.1类临床申报和1类新药临床申报为主,2018年上半年5.2类的临床申报有所上升。
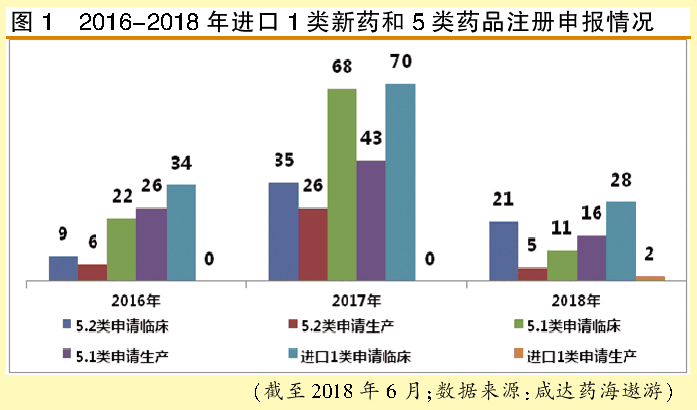 5.2类获批进口的目前仅有大冢制药的注射用头孢唑林钠,可视为通过一致性评价。5.2申报涉及印度、中国台湾、欧美的仿制药厂家,国内以第三方注册申报机构为主。例如诺华申报了沙美特罗替卡松粉吸入剂、左乙拉西坦片、糠酸莫米松鼻喷雾剂、草酸艾司西酞普兰片和伏立康唑片,印度瑞迪申报了枸橼酸西地那非口崩片、利伐沙班片、氟维司群注射液、碳酸司维拉姆片和醋酸阿比特龙片。
5.1类上市有“极速”通道
近期的进口获批潮主要来源于5.1类,即境外上市的原研药品申请境内上市,2017年共有15个进口药以5.1类获批,2018年上半年则有8个。
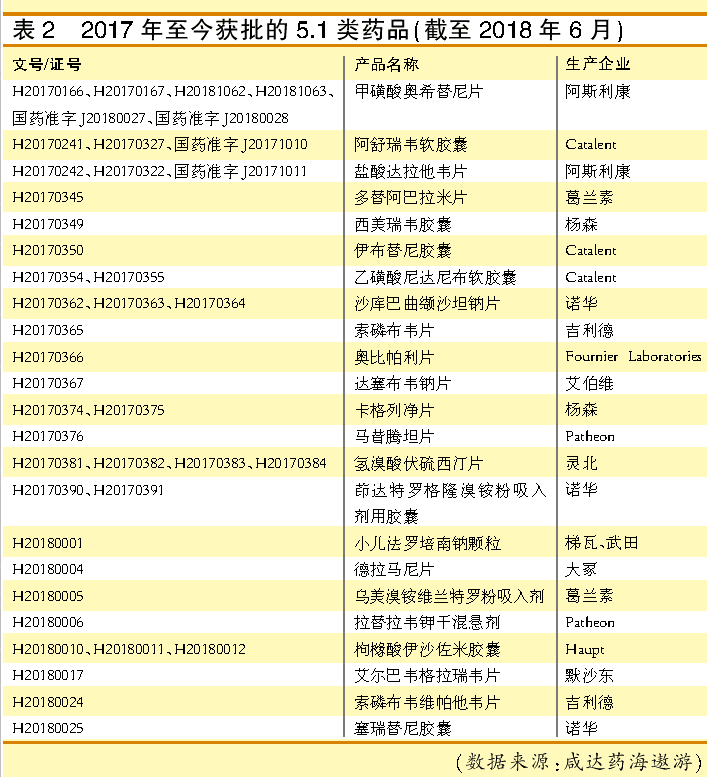 武田一线治疗多发性骨髓瘤药物枸橼酸伊沙佐米胶囊于2018年获批,2017年在我国启动Ⅲ期临床,虽未见其申报上市但已获批上市了。类似情况的产品还有吉利德的索磷布韦维帕他韦片。
这两个产品预计符合2018年5月23日发布“国家药品监督管理局 国家卫生委员会关于优化审评审批有关事宜的公告”(2018年第23号)中提到的“对于境外已上市的防治严重危及生命且尚无有效治疗手段以及罕见病药品,进口药品注册申请人经研究认为不存在人种差异的,可以提交境外取得的临床试验数据直接申报药品上市注册申请。”也就是说,对于这些情况,2018年5月23日前已受理并提出减免临床试验的上述进口临床试验申请,符合《药品注册管理办法》及相关文件要求的,可以直接批准进口而获批上市。
1类进口药仅1个申报上市
2016年至2018年上半年,唯一一个进口1类新药申报上市的是辉瑞的达克替尼(Dacomitinib),它在2018年上半年提交申请,为一线药物治疗晚期非小细胞肺癌(NSCLC)患者使用而研制的第二代人表皮生长因子受体(HER)抑制剂。
总结<<<
产品引进还需要考虑国内的产品已上市状况、市场规模和价格。从国家用药结构来看,目前只有原研进口没有仿制药并且价格相对较低的进口仿制药,以及原研药没有在国内上市的危重疾病、罕见病、儿科且缺乏有效治疗手段的进口仿制药,更有可能是加快引进的目标。
关键词:
|